2021. 12. 22. 09:52ㆍ열 물리학
지난번과 이어서 입자의 이동은 없고 에너지의 이동만 있을 때를 계속해서 고려해보며 지식들을 전개해 나가봅시다.
two systems in thermal contact with constant energy


systerm의 에너지는 u 이고 system 밖으로는 열을 주고받지 않으므로 u is constant
The combined system for given u, has the follwing number of microstates (muitiplicity)
The number of muitiplicity:

The large term has more micro states for given macrostate with energy u
The system proceeds into a macrostate that affords the largest possible number of microstates.
(거시 = 수많은 미시 세계)
we knew that the most probable state dominates with a magnitude large than the less probable state
The most Probable state (최빈상태) is the macrostate in which the system spends an overwhelming large fraction of time.
->equilibrium state of the system 평형상태

미분이 0이면 극 값을 알수있다.

N_1 ,N_2 는 입자수 뿐만 아니라 속박조건이기도 하다.

더 깔끔히 정리하면

위 식이 열평형 조건(Thermal Equilibrium condition) 이다.
(u_1 hat , u_2 hat은 g1 g2가 최대값이 되는 지점이다.)

앞서 열평형 조건(Thermal Equilibrium condition)를 이용하면

고전적인 열역학에서

으로 알려져있다.(S 는 엔트로피, T 는 온도)
고전 열역학의 열평형에서

식 (2) / (1) 으로 나누면

(사실 고전 열역학과 새로운 열물리에서 엔트로피의 비율이라고 보면 되겠습니다.)
Let this unviersal constant
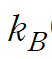
Boltzman constant (Max planck proposed) 라고 하겠다.


S is conventional entropy\
so


이때 tau는 에너지 차원을 갖는다.
추가적으로 주목할 점은

엔트로피 미분꼴이 같기때문에 logg 를 엔트로피라고 명하는 것이라 생각된다.

볼츠만 상수의 차원은 [에너지/온도] 인 것을 알게 되었습니다.
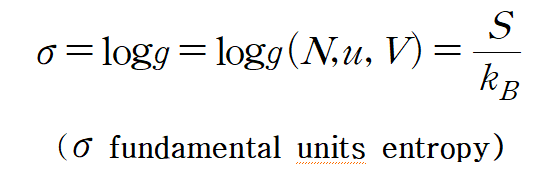

may depends on additional independent variables.
---------------------------------------------------------------------------------------------------------------------------------
★Example of Law of increase of entropy (엔트로피 증가법칙)

상황은 이렇습니다. 뜨거운 온도를 가진 system 1 차가운 온도를 가진 system 2가 있는데 이 둘이 열 접촉을 하면 어떻게 될까요? 를 묻는 문제입니다.
(문제1)

엔트로피의 변화량은?


tip. 엔트로피 시그마는 원래는 중복도함수에 로그를 씌운것과 같습니다. 그러면 본래함수는 g함수 인데, g=g(N,u,V) 등 각종 변수중 에너지 교환만있으므로 g=g(u) 입니다. 그 후 각 시스템끼리 전미분을 이용했지만 근사적으로 델타의 변화량을 그대로 이용하면 되겠습니다. (엔트로피 증가량 + 엔트로피 감소량 = 전체 변화량)


-> Final system will be in a more probable condition if energy flows probable from the warmer(더 따뜻한) body to the colder body. (일반적으로 뜨거운 곳에서 차가운 곳으로 열을 옮기면 엔트로피가 증가할 것입니다.)
★Example 2 뜨거운 구리와 차가운 구리

이번 상황 역시 위 예제와 같습니다. 구체적인 응용 예제라고 보면 되겠습니다.
구체적으로 궁금한 것은 다음 세가지 질문입니다.

(b) what is the change of entropy of two specimens(표본) when a transfer of 0.1J Taken place?
(c) increase of entropy?
(풀이)



'열 물리학' 카테고리의 다른 글
| [열 물리학 15] Law of Thermodynamics 열역학 법칙 (0) | 2021.12.25 |
|---|---|
| [열 물리학 14] Law of increase of Entropy (엔트로피 증가법칙) (0) | 2021.12.25 |
| [열 물리학 12] Most Probable Configuration(최빈 배열) (0) | 2021.12.17 |
| [열 물리학 11] Probability(확률 ), Ensemble (앙상블) (0) | 2021.12.17 |
| [열 물리학 10] Fundamental assumption of THERMAL PHSYSICS열 물리학에서의 기본가정 (0) | 2021.12.17 |